Прогноз
 Полный список прогнозов Полный список прогнозов
 Обязательное страхование, Новые страховые поля, Новый страховой продукт, Страхование жизни, Страхование от несчастных случаев Обязательное страхование, Новые страховые поля, Новый страховой продукт, Страхование жизни, Страхование от несчастных случаев
 Клиника испытаний – новые правила
Клиника испытаний – новые правила
Павленко Евгений Валерьевич
Председатель правления СОАО «Национальная Страховая Группа» (НСГ) до 02.02.2017 г.
|
 Прогноз развития рынка страхования жизни и здоровья участников клинических испытаний представляет Национальная Страховая Группа (НСГ). Прогноз развития рынка страхования жизни и здоровья участников клинических испытаний представляет Национальная Страховая Группа (НСГ).
В сентябре 2010 года вступил в силу законопроект «Об обращении лекарственных средств». Новый закон вводит процедуру обязательного страхования пациентов при проведении клинических испытаний лекарственных препаратов. Жизнь и здоровье пациента, участвующего в исследованиях, должна будет за свой счет страховать организация, получившая разрешение на проведение клинических испытаний.
Сфера клинических испытаний в России достаточно закрыта. Как быстро может измениться ситуация в новых условиях – вопрос не сколько времени, сколько инвестиций в реорганизацию производства и развития рынка клинических испытаний. Мы видим предпосылки для вполне успешного роста рынка в 2011 году.
Рынок страхования жизни и здоровья пациентов
Рынок клинических испытаний складывается из нескольких больших сегментов:
- исследования биоэквивалентности (совместимость с другими препаратами);
- локальные клинические испытания, проводимые для российского рынка;
- международные многоцентровые клинические исследования.
Как видно на графике, самым крупным сегментом из перечисленных является область клинических исследований, проводимых на международной многоцентровой основе – около 60% в 2009 году.
Второй сегмент по количеству – это локальные клинические испытания, проводимые для российского рынка (около 25% в 2009 году). Они проводятся как западными, так и российскими фармацевтами.
Наименьшее количество исследований проводится в области проверки биоэквивалентности – около 15% в 2009 году.
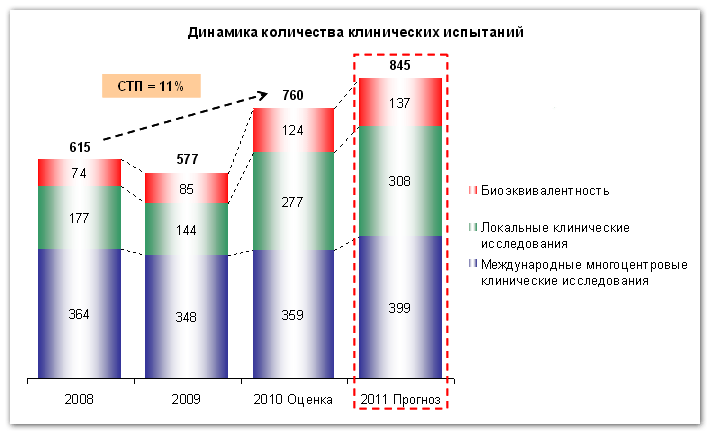
Согласно данным сборника «Клинические исследования в России. Оранжевая книга» исследовательской группы Synergy по итогам I полугодия 2010 года было проведено 312 клинических испытания лекарственных средств. Как показывают расчеты, по итогам текущего года количество исследований вырастет до величины 760 испытаний. Вместе с тем, количество клинических испытаний в будущем году вырастет на прогнозную величину около 11% и по итогам 2011 года составит 845 клинических испытаний.
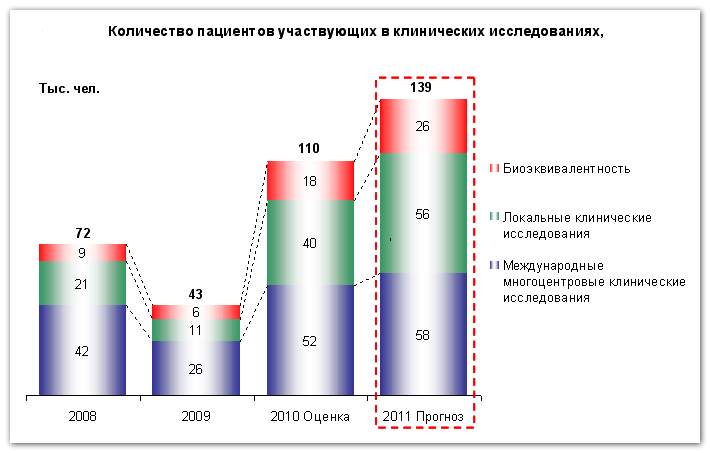
Одновременно в будущем году будет расти и количество пациентов вовлеченных в тестовые программы. По оценкам УМР НСГ, количество человек прошедших через данные программы, составит около 110 тысяч человек по итогам 2010 года, а в 2011 достигнет величины 139 тысяч человек. Необходимо отметить, что, вероятно, количество пациентов в различных сегментах будет расти разными темпами. Как следствие, наиболее быстрорастущим сегментом окажется исследование биоэквивалентности.
УМР НСГ был сделан прогноз сборов страховой премии на основе количества пациентов-участников клинических исследований, величине страховой премии по конкретному виду клинических испытаний и коэффициентам, оговоренным в Типовых правилах. Расчет проводился для трех условных сегментов данного рынка. С результатами можно ознакомиться в таблице.
Прогноз сборов премии по страхованию клинических испытаний в 2011 году
| Тип клинического исследования |
Премия на 1 пациента, руб. |
Количество пациентов |
Коэффициент тарифа |
Страховые сборы,
млн. руб. |
Доля вида клинических испытаний в сборах премии по виду, % |
| Международные многоцентровые клинические исследования |
9 811 |
57 788 |
0,9 |
510 |
69% |
| Локальные клинические исследования |
3 804 |
56 215 |
0,9 |
192 |
26% |
| Биоэквивалентность |
1 445 |
25 879 |
0,9 |
34 |
5% |
| Всего |
– |
139 883 |
– |
736 |
100% |
Как видно из расчетов, до 70% премии в 2011 году принесут страховщикам международные фармацевтические концерны, проводящие многоцентровые клинические исследования.
Остальные 30% сборов, скорее всего, будут распределены между прочими сегментами: локальными исследованиями и изучением биоэквивалентности.
В целом, данный рынок в 2011 году принесет страховщикам около 736 миллионов рублей страховой премии, при условии, что среднее количество пациентов, вовлеченных в испытание, окажется в диапазоне от 100 до 200 пациентов в одной группе, а общее количество пациентов в России достигнет прогнозируемых 139 тысяч человек.
Российский рынок клинических исследований
За последние годы наблюдается интенсивный рост как общего количества международных клинических исследований с участием России, так и рост количества вовлеченных в исследования центров на территории России. В первом квартале 2010 года Росздравнадзор РФ выдал 134 разрешения на все виды клинических испытаний, это на 18% больше, чем в соответствующем квартале прошлого года.
Сегодня Росздравнадзор допускает проведение клинических испытаний на базе 1500 лечебных учреждений.
Первое место среди отечественных производителей по количеству исследований, начатых в 2009 году, занимала ОАО Валента, инициировавшее 13 клинических испытаний. На втором месте — ЗАО «Фармацевтическое предприятие Оболенское» с таким же количеством исследований, но меньшим количеством пациентов; на третьем — «Канонфарма» (12). На четвертом — ЗАО «Биокад» (9). На пятом – «Микроген» с 8 новыми исследованиями.
В клинических испытаниях, начатых в I квартале 2010 года, принимает участие больше 13 тысяч пациентов, это на треть больше, чем в соответствующем квартале прошлого года.
Клинические испытания становятся как бы «моментом истины» для вновь разработанных лекарственных препаратов. На основании результатов испытаний и решается вопрос о целесообразности применения препарата во врачебной практике. От качества клинических исследований медицинских препаратов на добровольцах зависит успех по продвижению препарата в целом.
Проведение клинических испытаний становится частью процесса регистрации нового лекарства в России. Мировая практика вывода нового лекарства на рынок подразумевает длительные масштабные исследования эффективности и безопасности лекарственного препарата. Насколько этот процесс будет затянут в России, зависит от сроков ожидания разрешения проведения испытаний. С учетом того, что обычно фармкомпаниям приходится ждать разрешения несколько месяцев, угроза приостановки исследований становится реальной.
Правила
Положением закона предусмотрено проведение дополнительных клинических испытаний с участием российских пациентов при регистрации в России испытанных и зарегистрированных за рубежом лекарственных средств.
Согласно типовым правилам обязательного страхования жизни, здоровья пациента, участвующего в клинических исследованиях лекарств организаторы клинического исследования обязываются прилагать к договору обязательного страхования участвующих в исследовании пациентов их поименный список, с указанием паспортных данных, места работы и места жительства. Таким образом, документ требует раскрытия персональных данных пациентов третьим лицам (фармкомпаниям, страховщикам), что противоречит нормам медицинской этики и международной практике проведения клинических исследований1.
Новая редакция закона вызвала немало дискуссий на тему отличий от ранее действующих условий страхования.
В качестве оптимального варианта для получения разрешения на проведение клинических испытаний НСГ предлагает заключить предварительный договор с организатором исследований. Индивидуальные полисы страхования каждого пациента, участвующего в клинических испытаниях, выдаются после оформления договора обязательного страхования. НСГ гарантирует защиту персональных данных и конфиденциальность полученной информации.
Вопросов остается много. И у нас есть установка на разработку механизма, который поможет соблюдать все необходимые нормативы и урегулировать противоречия, затрудняющих работу страхователей и страховщиков.
1 Общепринятая основа проведения клинических испытаний во всех странах мира базируется на защите прав и достоинства человека, определенных в Хельсинской декларации 1964 года, подписанной всеми государствами. вернуться »
15 декабря 2010 г.
Версия для печати 
 Смотрите другие материалы по этой тематике: Обязательное страхование, Новые страховые поля, Новый страховой продукт, Страхование жизни, Страхование от несчастных случаев Смотрите другие материалы по этой тематике: Обязательное страхование, Новые страховые поля, Новый страховой продукт, Страхование жизни, Страхование от несчастных случаев
| В материале упоминаются: |
 Компании, организации: Компании, организации:
|
 |
 Персоны: Персоны:
|
|
 |
|
|